发现
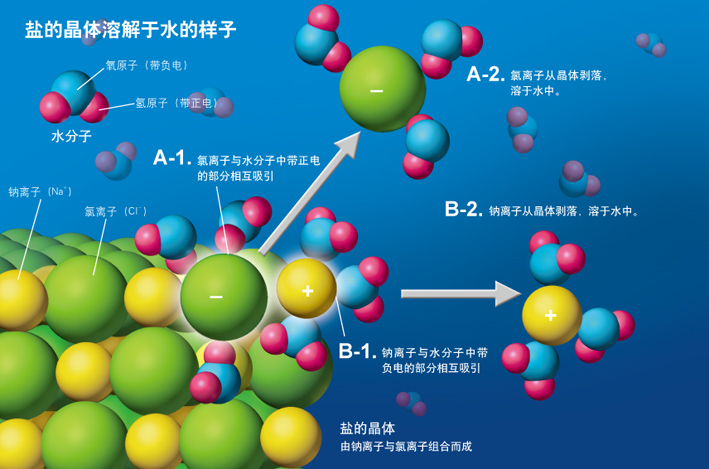
盐的晶体溶解于水的样子
将盐和砂糖分别溶解在水中,哪个可以导电呢?将盐或砂糖加入水中后,它们会渐渐溶解在水中消失不见。这时,溶解在水中的盐或者砂糖其实被分解为肉眼看不见的大小了。原本成块的晶体为什么在水中会被分解呢?略加思考我们就会发现,像"溶解"这样常见的现象中其实也隐藏着不可思议的事情。这次就让我们从原子水平上考察一下溶解的原理吧。这样我们就会搞清楚,水溶液在是否会导电这个性质上的差异是如何产生的了。
翻译/曹 曼

上图为构成盐分子的钠离子(黄色)和氯离子(黄绿色)溶解在水中的样子。这两种离子分散在水分子中,被水分子包围着。插图中每个离子周围画着3个水分子,实际上水分子的数目是不一定的。
仔细观察盐(氯化钠)的晶体颗粒会发现它基本呈方形。将盐加入水中后,起初可以观察到的晶体,由于渐渐溶解,最终就看不到了。这时水中究竟发生了什么?让我们从原子水平来观察一下吧。
盐是离子构成的物质
盐晶体是由带正电的钠离子(Na+)与带负电的氯离子(Cl-)组合而成的。由于两种离子所带电荷电性相反,在静电作用下相互吸引结合在一起。离子之间在静电作用下相互结合在一起就叫做"离子键"结合。
水分子中存在电荷群
接下来让我们确认水分子为何物。水分子是由一个氧原子与两个氢原子构成的。由于各个原子的原子核所带的正电荷与电子所带的负电荷相互抵消,水分子整体呈现电中性。但是就氧原子与氢原子来说,氧原子吸引周围电子的能力更强。因此在水分子中,氧原子周围会聚集电子,氧原子略带负电。另一方面,由于氢原子周围电子变少,所以氢原子带正电。
虽然水分子整体呈现电中性,但是电荷分布会偏向分子的某一端。这叫做"极性"。
被水分子包围,溶解开始
那么让我们看一下,当盐的晶体溶解到水中时究竟发生了什么。
当盐的晶体进入水中时,带负电的氯离子和水分子中的一部分氢原子相互吸引,带正电的钠离子与水分子中的一部分氧原子相互吸引(B-1)。如果有很多水分子聚集到各个离子周围,构成盐晶体的离子之间的结合就被弱化了。于是,离子就从盐的晶体上一个个剥离下来(A-2,B-2)。这样,盐的晶体就渐渐溶解了。
像盐这样,在水中会分解为带正电的离子(阳离子)和带负电的离子(阴离子)的物质叫做"电解质"。相反,在水中不能分解为离子的物质叫做"非电解质"。
溶于水的物质与不溶于水的物质
不能仅因为非电解质在水中无法分解为离子就说它肯定不能溶于水。举例来说,砂糖或葡萄糖就是溶于水的非电解质。在这里我们用比较简单的分子结构来看一下葡萄糖溶解的原理。
葡萄糖是由碳原子、氢原子、氧原子构成的分子。原子之间通过"共价键"的形式相互结合。实际上通过共价键连接的分子,即使溶于水也很难分解为离子形式。
由于葡萄糖分子中也有氧原子与氢原子构成的共价键部分,所以和水分子一样会发生极化。因此,当葡萄糖溶于水中时,首先水分子与一部分葡萄糖分子相互吸引(下方插图C-1)。和盐一样,如果葡萄糖分子被水分子包围,葡萄糖分子之间的结合就被弱化,从晶体上剥离下来(C-2)。即使是非电解质,如果分子发生极化,就会溶于水。
不太发生极化的非电解质分子几乎不溶于水。例如,由碳原子与氢原子构成的苯等有机化合物,还有油等。
附件: